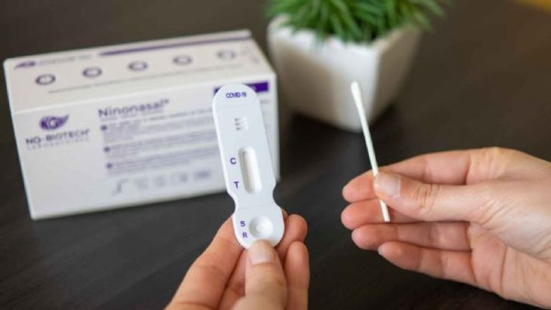
Se trata de cuatro kits que podrán comercializarse en farmacias de todo el país. Tienen instrucciones que ayudan a los usuarios a recoger su muestra.
La Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (Anmat) aprobó este miércoles la venta en farmacias de cuatro kits de autotest de coronavirus.
De acuerdo a lo indicado por el organismo, se trata de los productos Panbio COVID-19 Antigen Self-Test, SARS-CoV-2 Antigen Self Test Nasal, SARS-CoV-2 Antigen Rapid Test (COVID-19 Ag), WL Check SARS-CoV-2 Ag Self Testing fabricados por los laboratorios Abbott, Roche, Vyam Group y Wiener.
El usuario deberá seguir las instrucciones en el empaque para tomar la muestra e informar el resultado de la prueba de orientación diagnóstica dentro de las 24 horas de realizado el test, informó el organismo en un comunicado.
La decisión surgió tras el consenso del Consejo Federal de Salud (COFESA) y los reiterados reclamos del sector privado para poder acelerar el autocuidado frente al pico de casos positivos.
Aún no se conoce cuándo estarán disponibles en las farmacias debido a que con la reciente aprobación los laboratorios comenzarán con el proceso de importación.
La Anmat aclaró que estas pruebas «proporcionan resultados orientativos, sin valor diagnóstico concluyente, a excepción de que las jurisdicciones, en acuerdo con el Ministerio de Salud de la Nación y en base a la situación epidemiológica, consideren el resultado como positivo».
Asimismo, explicó que el autotest toma una muestra «a nivel nasal o bien por saliva», según lo especifique el fabricante, a diferencia de los test de uso profesional donde la toma de muestra es a nivel nasofaríngeo.
Por tal motivo, la muestra se debe tomar «en forma correcta y que de inmediato se realice la prueba para evitar resultados erróneos».
El resultado negativo de estos autotest no descarta la infección ya que «si la persona no tiene síntomas o si la carga viral es baja (lo que puede ocurrir durante los días iniciales o finales de la infección) el SARS-CoV-2 puede ser no detectado por el test».
«Para tener un seguimiento, los resultados deberán ser reportados de forma inmediata (en base al código de barra de cada empaque) una vez realizado el test, y se dispondrá de un plazo mayor cuando no hubiera sido utilizado, ya sea por el usuario individual o por un responsable de reporte en caso de gran volumen de test», precisó.
El resultado aportado por el usuario será alojado en la base informática farmacéutica y serán informados al Sistema Nacional de Vigilancia de la Salud (SNVS) por las agrupaciones farmacéuticas habilitadas.
Mientras que los casos positivos serán integrados a la notificación de casos de Covid-19, mientras que los negativos serán clasificados como «negativo, sin clasificar».
Por último, los casos de test inválido deberán repetirse para definir el resultado, explicó.
La novedad fue muy bien recibida por la Asociación de Propietarios de Farmacias (ASOFAR), cuyo presidente, Norberto Mañas, que consideró que su uso representa «una manera de descomprimir los centros de atención».
El directivo aseguró que la entidad dialoga con el Ministerio de Salud para «tratar el tema de la reglamentación de la iniciativa, y ver como informarán los pacientes el resultado de los test».
Sobre el tiempo que habrá que esperar para encontrarlo en las farmacias, afirmó que posiblemente se empiecen a vender «en los primeros días de la semana próxima» a un valor de «entre $2000 y $2500 aproximadamente».



